Perkembangan Teori Atom
Perkembangan Teori Atom
Pemikiran tentang hakikat materi, telah menjadi bagian penting dalam
perkembangan ilmu pengetahuan. Dalam setiap masa, selalu muncul pemikir-pemikir
yang berusaha untuk menyingkap rahasia di balik materi alam semesta ini.
Karenanya perkembangan pemahaman manusia
tentang atom, sebagai unit pembangun materi, memperlihatkan suatu pola
keteraturan yang luar biasa, sesuai dengan perkembangan daya pikir manusia dan
teknologi perangkat penyelidikan.
Ilmu kimia adalah ilmu yang mempelajari tentang materi dan perubahannya
serta perubahan energi yang menyertainya. Karena itu materi menjadi subjek
utama dalam bidang ini. Sehingga pemahaman seseorang mengenai materi adalah
prasyarat untuk dapat memahami perubahan yang terjadi padanya. Dari sini dapat
disimpukan bahwa konsep struktur atom adalah penting dan fundamental.
Untuk dapat memahami struktur atom secara benar, maka mengikuti
perkembangan pemahaman manusia tentang atom itu sendiri akan sangat bermanfaat.
Bagaimana penyelidikan keberadaan atom dari masa ke masa dapat dirangkum
seperti berikut
Pemikiran tentang Atom sebelum Dalton
Era panjang sebelum lahirnya teori atom Dalton, yang dianggap sebagai
teori atom modern pertama, berlangsung dari era pemikiran metafisik Yunani
sampai jaman renaissance. Teori atom
Dalton dipandang sebagai teori atom modern yang pertama karena merupakan hasil
kesimpulan dari berbagai gejala yang terjadi pada materi. Dalton juga meneliti
massa relatif dari atom-atom dengan membandingkannya dengan massa atom hidrogen
yang diberi massa atom satu, sesuatu yang baru dalam penyelidikan materi.
Walaupun beberapa pemikiran
sebelumnya juga tidak semata-mata bersifat metafisis, tetapi teori Dalton-lah yang dapat digunakan
untuk menjelaskan berbagai gejala yang terjadi pada materi. Juga teori
Dalton-lah yang disusun berdasarkan fakta empiris hasil eksperimen. Karena itu
teori Dalton dianggap sebagai teori modern.
Pandangan manusia tentang atom dan kekosongan diawali oleh Leucippus,
lahir 500 tahun sebelum masehi dan rekannya, Democritus, yang lahir 460 tahun
sebelum masehi. Democritus memperluas teori yang dikemukakan Leucippus dan
mempostulatkan penerapannya. Leucippus dikenal hanya menulis sedikit karya dan
pandangannya tentang atom termuat dalam The
Great World System. Democritus lebih produktif dalam menulis dengan sekitar
lima puluh dua karya tulis dengan beberapa di antaranya merupakan naskah
pendek. Termasuk dalam karyanya itu dia memperluas pandangan Leucippus tentang
atom dan kekosongan, dan delapan karya tentang etik (Wohnsigl, 2004).
Teori Leucippus merupakan reaksi terhadap teori Parmenides dan Zeno, dua
pemikir Yunani yang lain, merupakan kompromi antara akal sehat dan prinsip.
Parmenides dan muridnya, Zeno, percaya bahwa unsur pembentuk alam semesta adalah
yang maha Esa, yang tidak berbatas, meliputi segalanya, massa yang tidak
bergerak yang tidak berisi ruang kosong.
Leucippus menyatakan bahwa teori ini bisa jadi tidak benar, karena
pikiran sehat kita menunjukkan bahwa ada gerakan. Ia mendalilkan kekosongan
itu, ketidakhadiran dari semua yang ada, adalah hal penting bagi gerakan. Ia
juga mendalilkan bahwa suatu jumlah tanpa batas partikel yang disebutnya atom,
yang membentuk segala sesuatu yang ada dan penghancuran/pemutusan atom-atom
menyebabkan kerusakan materi.
Democritus mengembangkan teori Leucippus dengan mendeduksi Cosmogony, suatu metode terbentuknya
semesta, dengan berpikir bahwa semua materi terdiri dari atom, dan atom
memiliki densitas yang
berbeda-beda. Atom-atom akan
bergabung membentuk suatu pusaran atom. Materi yang lebih berat, karena pengaruh
gravitasi akan mengumpul di pusat dan membentuk bumi. Yang lebih ringan, dan
lebih baik akan terlempar pada bagian luar pusaran dan meningkatkan kecepatan
revolusi, kemudian membentuk heavenly
bodies. Teori ini jelas salah karena memandang bumi sebagai pusat
(geosentris), tetapi satu hal penting dari Leucippus dan Democtritus adalah
adanya ruang kosong (void), sesuatu
yang kemudian akan dibuktikan oleh Ernest Rutherford. Walaupun konsep ruang
kosong keduanya sangat berbeda: Leucippus dan Democritus mengatakan ruang
kosong harus ada di antara atom-atom, sedangkan ruang kosong Rutherford berada
dalam atom: sebagian besar volume atom itulah ruang kosong.
Jika dirangkum, maka pandangan Leucippus dan Democritus tentang atom
adalah sebagai berikut:
Pertama, semua materi tersusun
atas atom-atom, yang terlalu kecil untuk dapat
dilihat. Atom-atom ini tidak dapat dibagi lagi menjadi bagian yang lebih
kecil. Alasan Democritus menyatakan bahwa bagian terkecil dari materi adalah
atom yang tidak dapat dibagi lagi, karena jika pembagian dapat berlangsung
terus-menerus, maka materi yang telah terpisah-pisah tidak dapat disusun
kembali, dan kenyataannya tidak demikian. Suatu proses dapat bersifat reversibel.
Kedua, Terdapat ruang-ruang
kosong di antara atom-atom. Karena adanya ruang kosong ini menyebabkan
atom-atom dapat bergerak. Bergeraknya atom-atom inilah yang menyebabkan dapat
terjadinya perubahan materi dan sifat-sifat materi. Jika tidak ada ruang kosong (vacuum) maka atom-atom tidak dapat bergerak, dan tidak akan terjadi
perubahan materi.
Ketiga, atom berwujud padat,
dan di dalamnya sama sekali tidak terdapat ruang kosong.
Keempat, Atom-atom bersifat
homogen dan tidak mempunyai struktur internal. Pandangan ini praktis baru
terbantahkan pada saat J.J. Thomson menemukan
elektron.
Kelima, atom-atom memiliki ukuran,
bentuk, dan berat yang berbeda-beda.
Konsep atom ini kalah populer dengan konsep kontinuitas materi yang
dikemukakan oleh Aristoteles. Menurut Aristoteles, atom hanyalah sebuah
khayalan semata-mata, unsur sebagai penyusun materi haruslah bisa dinalar oleh
indra manusia. Karena itu Aristoteles menyatakan ada empat unsur penyusun
materi yaitu air, tanah, udara, dan api yang tersusun atas empat kualitas yang
berlawanan: panas – dingin dan basah – kering. Bahkan kemudian gereja katolik
menguatkan pandangan Aristoteles dan menyamakan ide atomistik sebagai Godlessness. Akibatnya sungguh dahsyat,
pemikiran tentang atom terhenti sampai abad pertengahan. Sebagai gantinya teori
empat unsur dari Aristoteles lebih banyak dirujuk, dan, suatu berkah dibalik
bencana, teori empat unsur melahirkan cikal-bakal al-kimia.
Setelah era keemasan Yunani menurun, pusat peradaban beralih ke timur,
ilmuwan- ilmuwan Arab menterjemahkan buku-buku Yunani, dan melanjutkan
penyelidikan tentang hakekat materi. Berdasarkan teori empat unsur dari
Aristoteles mereka berusaha mencampurkan satu ‘unsur’ dengan unsur lain untuk
menghasilkan emas. Ilmuwan Arab berhasil mengembangkan teknik-teknik analitik
seperti penyaringan, destilasi, dan filtrasi. Dari sini mereka menemukan bahwa
tanah, air, dan api bukanlah zat dasar
penyusun materi. Sehingga mereka mengembangkan ‘tiga kualitas’ sebagai gantinya, yaitu belerang yang mewakili sifat mudah
terbakar suatu zat, air raksa mewakili
sifat mengkilap, dan garam sebagai
hasil yang selalu terjadi ketika dua zat dicampurkan (Wospakrik, 2005).
Konsep atomos muncul kembali saat Pierre Gassendi (1592 – 1655) berhasil
memisahkan konsep atomisme dengan atheisme. Ini menyebabkan atomisme dapat diterima secara lebih luas. Saat itu, tahun 1624, parlemen Perancis telah
menyatakan bahwa siapapun yang mengajarkan paham yang bertentangan dengan
Aristoteles akan dihukum mati. Pada tahun 1649, Gassendi mempublikasikan
karyanya, Syntagma hilosophiae Epicuri, yang
terbagi menjadi tiga bagian: Logic, Physics, dan Ethics.
Sebelum mendiskusikan tentang atom, terdapat tiga bab dalam buku
Gasssendi yang menjelaskan pentingnya ruang kosong. Baru kemudian diikuti
penjelasan tentang teori atom Yunani:
bahwa atom tidak dapat diciptakan dan atau dimusnahkan, bahwa atom berwujud
padat, bahwa atom memiliki berat/massa, dan bahwa atom tidak dapat lagi dibagi.
Gassendi juga yakin, bahwa atom bukan hanya suatu “pemberhentian” geometris
belaka, tetapi atom memiliki ukuran tertentu, walaupun itu sangat kecil.
Satu perbedaan dengan konsep atom Yunani, dan ini yang menyebabkan dia
dapat memisahkannya dari atheisme, adalah bahwa menurutnya atom tidak kekal
eksistensinya, tetapi diciptakan oleh Tuhan. Pergerakan atom tidaklah a se ipsis (atas kemauannya sendiri)
tetapi dei gratia, merupakan
pemberian Tuhan. Menurut Gassendi atom-atom juga dapat bergabung membentuk molleculae atau corpuscula. Atom atom itu bergabung bukan karena gaya
elektrostatik, tetapi karena adanya gaya mekanik seperti kancing dan lubangnya
(Park, 1998).
Terdapat rentang sekitar 150 tahun dari masa Gassendi untuk memunculkan
John Dalton dari Inggris.
1. Teori Atom Dalton
Pernyataan yang kemudian terkenal sebagai teori atom Dalton, berawal dari
ketertarikan John Dalton terhadap cuaca. Sepanjang hidupnya dia mencatat
tekanan uap, kelembaban udara, kelarutan gas, dan campuran gas dalam atmosfir.
Bahkan sampai sehari sebelum meninggal, dengan tangan gemetar Dalton masih
mencatat cuaca hari itu. Dalton mempublikasikan metodenya untuk menentukan
berat atom, dan teorinya tentang atmosfir dan perilaku gas dalam bukunya, A New System of Chemical Phylosophy.
Hanya pada beberapa halaman terakhir bukunya tersebut Dalton memaparkan
teorinya tentang atom. Secara garis besar pandangannya tentang atom adalah
sebagai berikut:
Pertama, unsur-unsur terbuat
dari atom. Atom ini bersifat diskrit, tidak terbagi, dan tidak dapat mengalami
kerusakan/kemusnahan. Tentu saja ini bukan gagasan Dalton sendiri, tetapi
berasal dari atomisme Yunani. Yang perlu diingat adalah bahwa gagasan ini
bukanlah gagasan populer pada awal 1800, saat Dalton mempublikasikannya.
Definisi Dalton tentang unsur adalah sama dengan definisi saat ini, suatu
materi kimia yang tidak dapat didekomposisi lagi menjadi lebih sederhana dengan
cara-cara kimia biasa. Definisi ini mengacu pada Lavoisier. Atom Dalton dapat
diibaratkan seperti bola bilyard, yang tidak memiliki struktur sub atomik.
Kedua, atom-atom suatu unsur
adalah identik dalam hal massa. Konsep ini diketahui belakangan adalah salah
dengan penemuan isotop, tetapi perlu diingat konsep isotop baru diketahui 100
tahun kemudian.
Ketiga, atom-atom dari unsur
yang berbeda akan mempunyai massa yang berbeda pula. Ini juga bukan merupakan
pemikiran murni dari Dalton, tetapi juga bersumber dari atomisme Yunani. Yang
membedakan adalah Dalton-lah yang pertama kali menggambarkan perbedaan
tersebut, sementara sebelumnya hanyalah sebuah pernyataan tanpa bukti. Dalton
telah dapat menentukan massa atom relatif dari suatu unsur.
Keempat, atom-atom bergabung
dalam perbandingan yang bulat dan sederhana. Pernyataan ini merujuk pada hukum
perbandingan tetap dari Joseph Louis Proust pada 1797. Penemuan Dalton adalah
hukum kelipatan perbandingan, yang dirumuskan dari penyelidikannya terhadap
oksida nitrogen. Secara modern hukum ini dinyatakan, atom-atom
dari suatu unsur
dapat bergabung dengan
lebih dari satu macam perbandingan dengan suatu atom unsur lain untuk membentuk lebih
dari satu senyawa.
Ide kelima yang implisit dalam
teori Dalton tetapi biasanya tidak dibicarakan adalah bahwa atom tidak dapat
diciptakan atau dimusnahkan. Atom-atom suatu unsur tidak berubah selama reaksi
kimia, contohnya atom oksigen dan nitrogen tetap berada sebagai dirinya dalam
keadaan sebagai senyawa, dan dapat didekomposisi untuk kembali menjadi unsur
bebas (Park, 1998) .
 |
| Teori atom dalton |
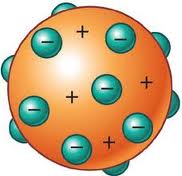
2. Model Atom Thomson
J.J. Thomson melakukan penyelidikan terhadap atom dengan menggunakan
tabung sinar katoda (Cathode Ray Tube =
CRT). Dengan alat ini Thomson menemukan elektron (yang disebutnya corpuscle) sebagai partikel sub atomik
dalam atom pada 1896. Penemuan ini mematahkan anggapan bahwa atom merupakan
partikel terkecil yang tidak mengandung struktur yang lebih elementer.
J.J. Thomson sampai pada kesimpulan bahwa elektron (corpuscles) merupakan partikel penyusun semua atom, karena dengan
menggunakan katoda yang berasal dari unsur berbeda-beda, jenis sinar yang
dipancarkan adalah sama. Pernyataan ini layak dicatat karena keberaniannya
untuk menyatakan sinar katoda merupakan suatu partikel
Diagram tabung sinar katoda dapat dilihat pada gambar II.1. Sinar dari
katoda dilewatkan melalui celah sempit pada anoda. Pada daerah tertentu dari
tabung dipasang pelat deflektor yang dihubungkan dengan kutub baterai. Jika
hubungan dengan baterai pada pelat deflektor diputuskan, maka jalannya sinar
katoda adalah lurus. Tetapi ketika baterai dipasang, maka sinar katoda
dibelokkan pada daerah tersebut mendekati kutub positif baterai. Percobaan ini
membuktikan bahwa sinar katoda bermuatan negatif.
Untuk menentukan nilai perbandingan muatan dengan massa elektron
(e/m), Thomson memasang dua kutub
berlawanan dari suatu magnet listrik pada sisi tabung pada daerah pelat
deflektor. Pemasangan sedemikian rupa sehingga garis gaya
medan magnetnya menyilang tegak lurus garis medan listrik antara pelat
deflektor. Kekuatan medan magnet diatur sedemikian rupa sehingga mengakibatkan
pembelokan sinar katoda yang sama besar tetapi arahnya berlawanan dengan
pembelokan oleh medan listrik. Dengan mengukur besar medan listrik dan medan
magnet dapat ditentukan besar harga e/m (Wospakrik, 2005).
 |
| teori atom thomson |
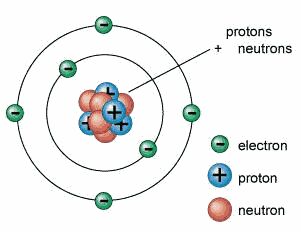
3.Teori Atom Rutherford
Ernest Rutherford,
ilmuwan besar yang berhasil menemukan inti atom. Bekerja di laboratorium
Universitas Manchester, Rutherford bekerja sama dengan Hans Geigerdan seorang mahasiswanya
bernama Ernest Marsden, menyelidiki hamburan sinar alfa sejak 1898.
Rutherford menduga
simpangan gerak partikel alfa yang melewati lembaran tipis emas dari arah
datangnya semula akan memiliki sudut simpangan yang kecil. Hal ini karena
partikel alfa bergerak sangat cepat, sekitar 160.000 km/s dan lembaran emas
yang dilewati hanya setebal 0,006 cm.
Hasil percobaan sungguh
di luar dugaan. Dilaporkan oleh Geiger bahwa terdapat beberapa berkas sinar
alfa yang dipantulkan balik. Komentar Rutherford yang menjadi
terkenal, ”Tidak masuk akal! Ini sama halnya dengan anda menembakkan peluru
berdiameter 15 inchi pada selembar kertas tissue kemudian
mendapati bahwa peluru tadi terpantul balik menembaki Anda.”(Krane, 1992).
Penjelasan yang mungkin
untuk ini adalah bahwa atom tidaklah benar-benar pejal, tetapi berisi ruangan
kosong. Massa atom pasti terkonsentrasi dalam inti atom yang
disebutnya teras atom, sehingga ketika sinar alfa yang bermuatan
positif dan massa atom jauh lebih kecil dari atom emas menumbuknya
akan terpental tanpa inti itu mengalami perubahan posisi. Ini sama seperti
kelereng yang menabrak bola besi dengan diameter jauh lebih besar, kelereng itu
akan terpental dan bola besinya tidak berubah.
Di samping itu percobaan
menunjukkan bahwa hampir seluruh berkas sinar alfa diteruskan tanpa mengalami
pembelokan arah, dan sebagian kecil, 1 berkas sinar alfa tiap 200 berkas
dibelokkan dengan sudut kecil, sekitar 2˚. Dan hanya sedikit sekali berkas
(Geiger – Marsden melaporkan 1/8.000 untuk lembaran tipis platinum dan
Rutherford melaporkan 1/20.000 untuk lempeng emas) sinar alfa yang dipantulkan
dengan sudut pantulan mencapai 90˚ atau lebih. Hasil ini membimbing
Rutherford pada suatu kesimpulan yang berseberangan dengan J.J. Thomson,
sehingga ia menemukan inti atom, yang disebut oleh Rutherford sebagai "charge
concentration" dalam makalahnya pada tahun 1911. Istilah inti atom (nucleus)
baru digunakan dalam bukunya yang diterbitkan pada tahun 1912. Dalam makalahnya
tersebut, Rutherford menulis, "We shall suppose that for distances less
that 10¯12 cm the central charge and also the charge on the alpha particle
may be supposed to be concentrated at a point."
Karena itu Rutherford
memberikan model bahwa atom dengan radius 10-12 cm dengan
sebagian besar volume atom merupakan ruang kosong, dengan inti atom pada
pusatnya sebagai sebuah titik di mana terjadi konsentrasi muatan positif.
Elektron- elektron berada pada jarak yang jauh dari inti atom. Jika dilakukan
perbesaran sampai inti atom sebesar kelereng dengan diameter 2 cm, maka atom
telah kira-kira sebesar bumi.
Rutherford tidak punya
ketertarikan untuk mempelajari lebih jauh bagaimana atom dapat stabil tanpa
elektron jatuh ke dalam inti atom. Rutherford menulis pada bagian awal
papernya, "The question of the stability of the atom proposed need
not be considered at this stage, for this will obviously depend upon the minute
structure of the atom, and on the motion of the constituent charged
parts." Persoalan ini dijawab seorang berumur duapuluh tujuh
tahun, Neils Bohr.
 |
| Teori atom rutherford |
4. Teori Atom Bohr
Pada tahun 1913, Neils
Bohr mengemukakan bahwa atom ternyata mirip dengan sistem tata surya, dengan
elektron-elektron mengitari inti atom seperti halnya planet- planet mengitari
matahari. Dengan alasan yang sama bahwa sistem tata surya tidak runtuh karena
tarikan gravitasi antara matahari dan tiap planet, atom juga tidak runtuh
karena tarikan elektrostatik coulomb antara inti atom dengan tiap elektron.
Dalam kedua kasus ini, gaya tarik berperan memberikan percepatan sentripetal
yang dibutuhkan untuk mempertahankan gerak edar (Krane, 1992). Menurut Bohr,
elektron tidak bergerak menurut lintasan yang sembarang, tetapi pada lintasan
tertentu yang disebut lintasan stasioner. Dalam lintasan ini, elektron tidak
kehilangan energi selama bergerak.
Besarnya momentum anguler elektron dalam lintasan ini memenuhi persamaan
mvr =nh/2p, di mana n disebut bilangan
kuantum utama dengan harga yang diijinkan 1, 2, 3 dan seterusnya.
Elektron dapat
berpindah dari lintasan stasionernya ke lintasan dengan tingkat energi lebih
tinggi, jika menyerap energi (foton) yang cukup, dan sebaliknya dapat kembali
ke lintasan stasionernya dengan melepaskan foton. Model atom Bohr ini dapat
menjelaskan dengan memuaskan spektrum garis dari gas hidrogen dan atom
berelektron satu lainnya (hydrogen like). Kebenaran teori Bohr ini dapat
dibuktikan dengan eksperimen yang dilakukan oleh James Frank dan Gustav Hertz,
dua orang ilmuwan Jerman. Mereka menggunakan sebuah tabung yang diisi dengan
uap raksa di mana elektron dapat dipercepat dengan medan listrik dengan
potensial U1 dan sebelum elektron menabrak anoda kemudian diperlambat dengan
U2, di mana U2 < U1.
Hasil ini membimbing
pada satu kesimpulan bahwa eksitasi pada atom air raksa bersifat diskrit. Mula mula elektron secara
konstan dipercepat dan
bertumbukan secara elastis dengan atom-atom raksa. Akibatnya arus akan
naik. Ketika elektron dipercepat maka energi kinetiknya (Ekin = e U1) naik, dan
ketika energi kinetik elektron mencapai tingkatan tertentu di mana harganya
sama dengan tingkat energi pertama dari elektron dalam atom raksa maka elektron
akan memberikan semua energi kinetiknya kepada elektron raksa sehingga
mengalami eksitasi. Karena energi kinetiknya berkurang, elektron tidak dapat
melalui daerah perlambatan, maka arus akan menurun. Hal ini akan berulang untuk
setiap kelipatannya (Bronner ,2006).
 |
| Teori Atom Bohr |




No comments